为啥统计表中患者基数可以不同?浅谈临床试验数据集的划分
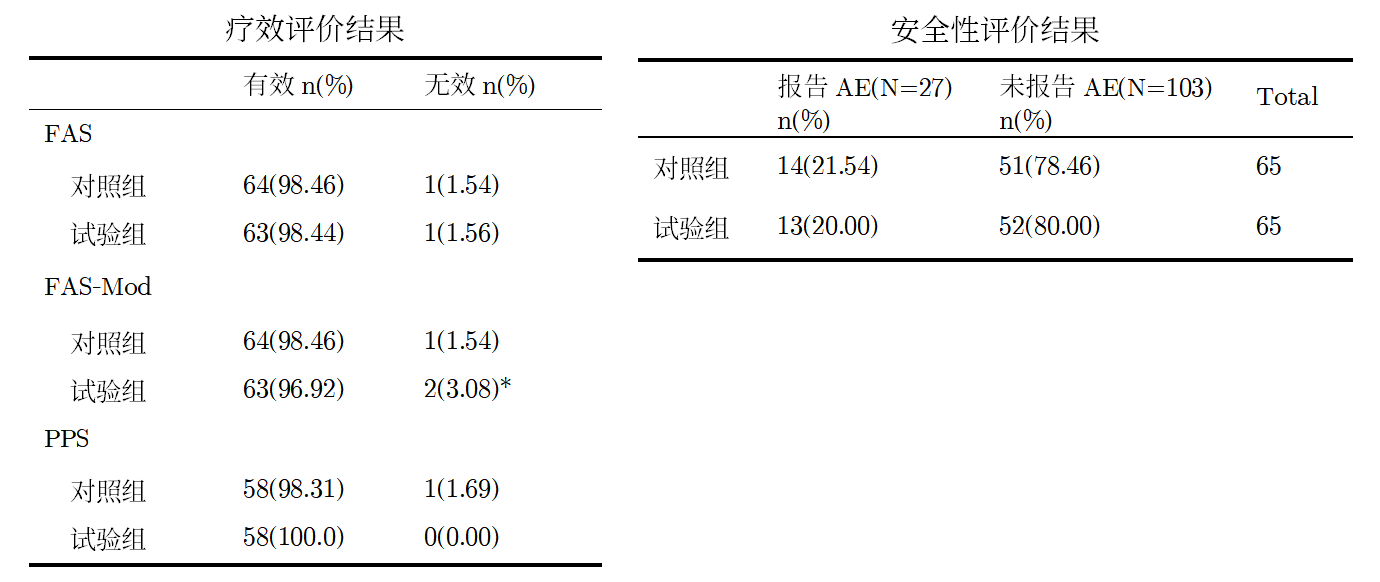
上周给博士班上完课,有同学问了一个问题:写论文时,不同统计表中的患者例数(基数)是否可以不同?结论:当然可以,比如下面这两个出自同一研究的统计表。简单来说:不同的统计分析过程有不同的目的。比如我们分析患者在研究期间发生的不良事件情况,目的是安全性评价,而对比有效率的高低,目的是疗效评价。所以从实践角度,我们在同一个临床试验中得到的数据,为了分析疗效和安全性,会分为疗效和安全性两个数据集。根据ICH

上周给博士班上完课,有同学问了一个问题:写论文时,不同统计表中的患者例数(基数)是否可以不同?结论:当然可以,比如下面这两个出自同一研究的统计表。简单来说:不同的统计分析过程有不同的目的。比如我们分析患者在研究期间发生的不良事件情况,目的是安全性评价,而对比有效率的高低,目的是疗效评价。所以从实践角度,我们在同一个临床试验中得到的数据,为了分析疗效和安全性,会分为疗效和安全性两个数据集。根据ICH

在新药研究中,都说RCT是临床试验金标准,而对照(Control)又以安慰剂(Placebo)对照为首选,但在实际操作中,因为伦理原因,很多适应症不可能只用安慰剂,如常见的心脑血管疾病、糖尿病、肿瘤等等。为了达到“与安慰剂对照”的效果,在研究设计中,常常设置一个所有患者都接受的基础治疗,在此基础上,再分别给予试验药或安慰剂。这种研究设计,严格来说不能称之为安慰剂对照,它属于复合处理对照,以A示基础
即使严格按照样本量计算结果确定研究规模,实施的结果也未必是达成目的。也就是样本量计算结果的可靠性,它取决于以下几个影响因素:1、在计算样本量时,所选择的把握度(Power = 1 - β )越大(当然,所需的研究规模也越大),达成研究目的的可靠性越高;2、计算样本时所设定的试验组、对照组的效应值越准确(越接近研究中的真实情况),达成研究目的的可靠性越高;所以,不要为了减小样本量计算结果,而刻意地低
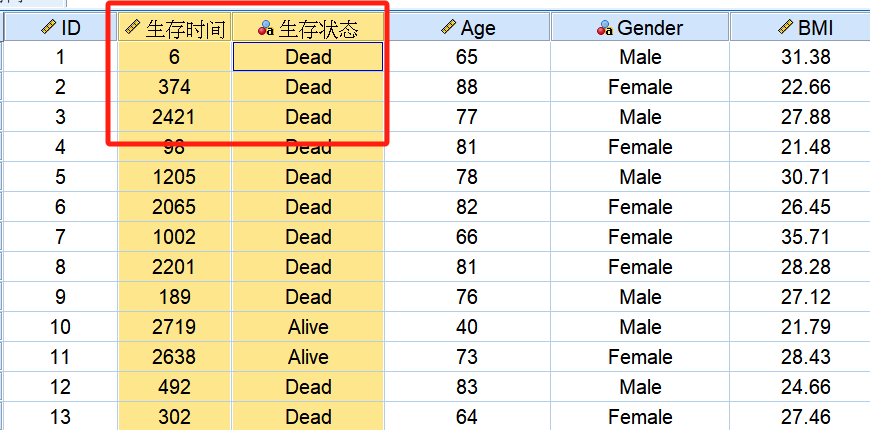
很明显,这篇文章没有任何的技术性可言,写给临床试验行业的统计小白,普及一点生存分析的基本概念和基本常识。OS(overall survival),总生存时间,一般定义为从随机化(也可以是首次用药时间)至死亡的时间长度;这个指标几乎是任何肿瘤相关临床试验中都会采集的数据。所以OS(以及任何其它生存时间)的计算,肯定涉及两个时间点,一个起始时间、一个结局时间。起始时间,只要入组的受试者都会有,如随机化
样本量计算的目的:在一定检验效能(把握度)基础上,确定研究的最小规模。计算过程1、明确假设(1)明确研究设计类型,如完全随机、配对或随机区组设计;(2)确定研究的主要终点指标,也就是拿研究结果中最重要的那一个指标,作为计算样本量的依据;(3)上述主要终点指标的类型,是计量的还是计数的,是二分类还是多分类,是无序还是无序?2、指定检验水准一般双侧检验(即差异性检验)选定α=0.05,单侧检验α=0.

这个问题本来也没什么可说的,因为将近10年前,导师执笔的专家共识中已经明确:2016年FDA发布的指南当中也有相关的描述,和上述论文中给出的实践标准一致。可是近些年有一些其他作者,也包括一些国外的SCI论文中,对于非劣效临床试验的样本量计算问题,在实际举例时,采用了α=0.05的设定(其实是双侧),这就给人一种错觉,好像我们可以将传统假设检验0.05的水准,原封不动地应用于非劣效试验。对于非劣效的
既然DeepTech深科技号称是关注三个方面:基于科学的发现;真正的科技创新;深科技应用的创新。既然你们要以科学的名义进行评价(review?),那么:一、关于文章的题目虽然你们写的不是论文,但尚未起跑已分高下,这样的题目,想要告诉读者什么?你们这个标题,起得足够科学吗??这和标题党有多大的区别?二、关于针对的患者人群(trial population)原文:两个试验,一个注册在国内的世卫组织临床
Wiki百科给出的多中心临床试验的定义非常简单[1]:A multicenter research trial is a clinical trial conducted at more than one medical center or clinic. 即其认为只要参与临床试验的临床中心或诊所数量超过1个,这个试验就是多中心的。而我国的《医疗器械临床试验质量管理规范》[2](国家食品药品监督管
CRF(病例报告表)作为临床试验/研究中,收集数据的载体(可能是纸质或电子化的),重要性不言而喻。良好设计的CRF可以使数据收集工作事半功倍,同时也有助于统计分析工作的顺利完成。一份设计良好的CRF,收集的数据应能够覆盖方案中规定收集的所有数据,而且没有重复收集的数据。然而,现实的情况,不容乐观。从经历的多个项目的CRF设计来看,设计中的问题很多,突出的是CRF的设计没有以方案与统计为目标,成了试
临床研究:clinical study临床试验:clinical trial就临床研究与临床试验而言,在书面的使用上其实区分并不明显,在英文中常是混用的。比如ICH的GCP(E6)中,就使用:Clinical Trial/Study 这样的形式来表述一个概念,并且在最后还特别注明了:"The terms clinical trial and clinical study are synonymou